Als Biofilm bezeichnet man eine Schleimschicht, die von Mikroorganismen gebildet wird.1 Sie dient dem Schutz der eingebetteten Bakterien vor dem Immunsystem, gleichzeitig werden die enthaltenen Mikroorganismen auch unempfindlicher gegenüber Antibiotika. Doch wie entsteht eigentlich ein Biofilm? Und was kann man dagegen tun?
Biofilme finden sich auf verschiedenen Oberflächen, wie beispielsweise unseren Zähnen oder medizinischen Implantaten.1 Die häufigsten Erreger in Biofilmen sind Staphylokokken, Pseudomonaden und Streptokokken.1 Ein Biofilm entsteht, wenn Mikroorganismen an einer Oberfläche anhaften und eine Mikrokolonie bilden.2 Dabei produzieren sie eine Matrix aus Proteinen und Polysacchariden, welche die Bakterien schützt und die weitere Ansiedlung ermöglicht.3 Der Biofilm wächst umso stärker, je mehr Bakterienspezies hinzukommen.4
Der Biofilm bietet den Bakterien einige Vorteile – denn neben Schutz finden sie hier auch stabilere Lebensbedingungen vor. Dadurch können beispielsweise Phasen mit Nahrungsmangel besser überstanden werden.2 Aus dem Biofilm brechen auch immer wieder Bakterien aus, um auf Wanderschaft zu gehen, denn normalerweise sind die Mikroorganismen nicht sesshaft.2
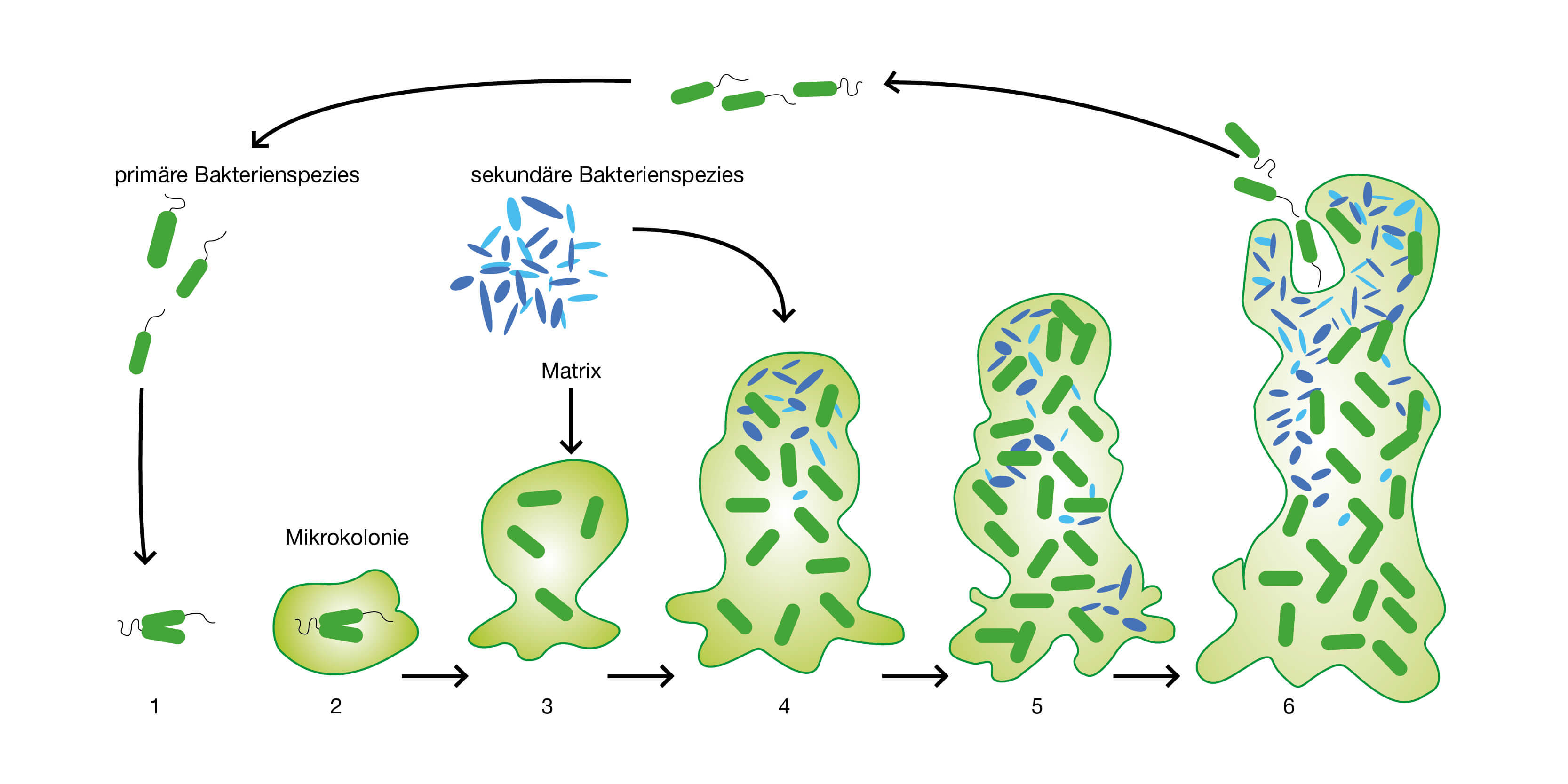
Abb. 1: Lebenszyklus eines Biofilms (mod. nach 5).
(1) Reversible und irreversible Bindung an Oberfläche.n(2) Produktion extrazellulärer polymerer Substanzen und Bildung von Mikrokolonien. (3-5) Biofilmwachstum und Ansiedlung weiterer Spezies. (6) Ablösung von Zellen und mögliche Rückkehr zur planktischen Lebensweise (Dispersion), Möglichkeit der neuen Biofilmbildung.
Verzögerte Wundheilung durch Biofilme
Besonders in Wunden stellen Biofilme ein medizinisches Problem dar, denn sie sind meist schwierig zu beseitigen und verzögern die Wundheilung.1,6 Biofilme sind nachweislich in 75 % der stagnierenden und in 78 % aller chronischen Wunden vorhanden und vermutlich die Hauptursache für chronische Infektionen.7,8 Sie reduzieren die Wirksamkeit von Antiseptika und Antibiotika, was die Wundsituation unter Umständen noch verschärfen kann.9
Gegen den Biofilm
Bei Verdacht auf einen Biofilmbelag in einer Wunde sollte Folgendes beachtet werden:6
- Durchführen eines regelmäßigen Debridements
- Applikation von antimikrobiellen Wundauflagen
Besonders das mechanische Debridement ist wichtig, um den Biofilm zu durchbrechen.10 Die Bakterienlast in einer Wunde kann durch das Debridement um das 10- bis 100-Fache reduziert werden.11
Debrisoft® – den Biofilm fest im Griff
Für ein schnelles, einfaches und schmerzarmes mechanisches Debridement empfiehlt sich Debrisoft®. Es entfernt zuverlässig Debris und Exsudat aus der Wunde, neu eingewachsenes Granulationsgewebe und Epithelzellen werden dabei jedoch geschont. So kann der Biofilm zu 99,9 % entfernt werden.12
Nach dem Debridement
Das erfolgreiche Biofilmmanagement setzt eine antimikrobielle Behandlung nach der Wundreinigung voraus.12 Hierfür bieten sich antimikrobielle Wundauflagen, wie Suprasorb® P + PHMB an, denn sie können Bakterien abtöten und das Rekontaminationsrisiko vermindern.
Um eine weitere Wundheilungsverzögerung zu verhindern, sollte die Wunde bei jedem Verbandwechsel beurteilt und dokumentiert werden.6 Biofilme können hartnäckig sein und sich innerhalb eines Tages neu bilden. Deswegen ist ein regelmäßiger Verbandwechsel mit Debridement unumgänglich.
Sie wollen noch mehr über Biofilm erfahren? In unserem Video beantwortet die Expertin Dr. Cornelia Wiegand vom Universitätsklinikum Jena viele Fragen rund um die Entstehung und Entfernung von Biofilm. Schauen Sie doch mal rein!
Referenzen
- Deutsches Zentrum für Infektionsforschung, Glossar: Biofilm. Online erhältlich unter: https://www.dzif.de/de/glossar/biofilm (zuletzt zugegriffen am 07.07.2020).
- Pharmazeutische Zeitung, Mikrobielle Biofilme: Gemeinsam zur Attacke, Ausgabe 03/2015. Online erhältlich unter: https://www.pharmazeutische-zeitung.de/ausgabe-032015/gemeinsam-zur-attacke/ (zuletzt zugegriffen am 07.07.2020).
- Flemming H C, Wingender J. The biofilm matrix. Nature Rev Microbiol 8 (2010) 623-633.
- Nadell C C, Xavier J B, Kevin R F. The sociobiology of biofilms. FEMS Microbiol Rev 22 (2009) 206-224.
- Kostakioti M, et al. Cold Spring Harb Perspect Med. 2013; 3(4): a010306.
- Rechtsdepesche, Biofilm – der Feind der Wundheilung, März 2019. Online erhältlich unter: https://www.rechtsdepesche.de/biofilm-in-chronischen-wunden-gezielte-massnahmen-gegen-den-unsichtbaren-feind/ (zuletzt zugegriffen am 07.07.2020).
- Malone M, et al. 2017. The prevalence of biofilm in chronic wounds: a systematic review and meta-analysis of published data. JWC; 20–25.
- Wolcott R, Sanford N, Gabrilska R, et al. Microbiota is a primary cause of athogenesis of chronic wounds. J Wound Care WUWHS Suppl 2016:25(10):S33-S43.
- Percival SL, Bowler PG, 2004. Bio lms and their potential role in wound healing. WOUNDS, 16: 234–240.
- Data on File, Lohmann & Rauscher.
- Reddersen K, et al. In vitro evaluation oft he capacity of a monofilament debrider to remove biofilm and the efficacy of different wound dressings to prevent biofilm regrowth, Poster EWMA, Madrid, 2014.
- Produktseite Debrisoft®. Online erhältlich unter: https://www.lohmann-rauscher.com/de-de/produkte/niedergelassener-bereich/wundversorgung/debridement/debrisoft/ (zuletzt zugegriffen am 07.07.2020).


